原子结构
发布时间:2011/12/13 9:22:31 访问次数:2441
所有的物质都是由原子构成的,而原子又是由电子、质子和中子组成。在这一节,你将会学习到有关原子的结构(atomic structure),电子轨道和能阶理论,价电子,离子和两种半导体材料——硅和锗。半导体材料是很重要的,因为原子内部某些电子的形态,决定该材料如何传导电流。
在学完本节内容后,休应该能够:参与讨论原子的基本结构;定义出原子核、质子、中子和电子;说明元素的原子序数;说明电子的能阶;说明何谓价电子;说明离子化现象;说明何谓自由电子。
原子是能够保持元素特性的最小粒子。已知的109种元素都拥有原子,而且每个元素的原子与别的元素都不相同。这使得每一种
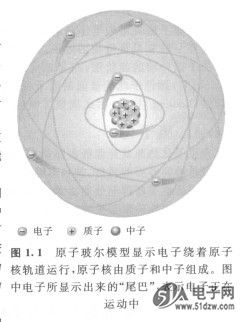
元素都拥有唯一独特的原子结构。依照古典玻尔的模型, R02115原子拥有一种像星体运行的结构,原子中心是原子核而周围是按照轨道并按轨道运行的电子,如图1.1所示。原子核是由带正电荷的粒子(称为质子)和不带电荷的粒子(中子)所组成。带负电的基本粒子称为电子。
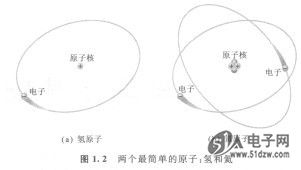
每一种原子都拥有一定数目的电子和质子,而且与其他元素的原子都不相同。例如,最简单的原子就是氢原子,只有一个质子和一个电子,如图1.2(a)所示。另一个例子就是氦原子,如图1.2(b)所示,原子核有两个质子和两个中子,另有两个电子围绕着该原子核运行。
1.原子序数
所有元素在周期表上都是按照原子序数排列。原子序数( atomic number)等于原子核申质子的数目,也等于电平衡(电中性)时原子所拥有的电子数目。例如,氢的原子序数是1而氦的原子序数是2。在正常(中性)情况下,元素的所有原子都拥有相同数目的质子与电子;正电荷就会与负电荷互相抵消,于是原子就不带任何净电荷。
2. 电子能阶层和轨道
电子绕着与原子核某些特定距离的轨道运行。电子越接近原子核,则它所具有的能量较远离原子核的电子能量越低。我们知道在原子结构中,电子只拥有分散且特定的能量。因此,电子必须绕着几个离原子核特定距离的轨道(orbit)运行。
每个距原子核特定的距离(轨道)就会对应一个能阶。在原子内,这些轨道会分群归纳为数个能量带,称为能阶层。原子都具有固定数目的能阶层。每个能阶层在允许的能阶上(轨道),都只能容纳一定上限数目的电子。在同一个能阶层内的能阶之间存在的能量差,远小于能阶层之间的能量差。能阶层按照1、2、3…顺序编号,能阶层1最接近原子核。能阶层也有用K、L、M--等字母编号,能阶层K最接近原子核。在图1.3中,说明这种能阶层的观念,图中显示出第一个能阶层含有一个能阶,而第二个能阶层含有两个能阶。依照不同的元素,不同形态的原子就存在着不同数目的能阶层。

3. 价电子
远离原子核轨道的电子具有较高的能量,比较接近屎子核的电子所受到的束缚力较大。这是由于带正电荷的原子核和带负电荷的电子之间的吸引力,随着与原子核之间距离的增加而减小。具有最高能量的电子都位于最外层的能阶层,相对地受到原子的束缚力也较少。这个最外的能量层就是所谓的价能阶层( va-lence shell),而位于此能量层的电子称为价电子(valence electrons)。这些价电子促成化学反应和材料结构中的键结( bonding)构成,因此决定了材料的电特性。
4.离子化
当原子从热源或光源吸收能量后,电子的能量就会提升。价电子受到原子的束缚力较内层电子微弱,当吸收到足够的外界能量后,就很容易地跳到价能阶层中更高的能阶轨道上。
如果价电子获得充分的能量,它就能够实际脱离最外层的能阶层和原子核的束缚。价电子的离开,会让先前属于电中性的原子变成带正电荷的状态(此时质子的数量多于电子)。失去价电子的过程就是所谓的离子化(ionization),而形成的带正电荷的原子就称为正离子。例如,代表氢的化学符号是H。当一个中性的氢原子失去它的价电子而成为正离子时,就将它表示为H+。脱离的价电子就称为自由电子。当自由电子失去能量,并且落回到呈电中性氢原子钋层的能阶层时,此氢原子就带有负电(因为,此时电子数量多于质子),称为负离子,表示为H-。
5. 每个能阶层所拥有的电子数
原子的每个能阶层所能容纳最多电子的数目,是自然现象,可以按照下述的公式计算出来:
Ne=2n2 (1.1)
其中,n是能阶层的编号。最内层的能阶层编号为K,再外一层编号为L,如此排列下来。最内层的能阶层能够容纳的电子数最多为
Ne=2n2=2(1)2=2
第二层的能阶层能够容纳的电子数最多为
Ne=2n2 =2(2)2 =2(4) =8
第三层的能阶层能够容纳的电子数最多为
Ne=2n2=2(3)2=2(9)=18
第四层的能阶层能够容纳的电子数最多为
Ne=2n2=2(4)2=2(16)=32
原子除了最外一层(价)能阶层外,所有内部的能阶层都需要填满电子。
所有的物质都是由原子构成的,而原子又是由电子、质子和中子组成。在这一节,你将会学习到有关原子的结构(atomic structure),电子轨道和能阶理论,价电子,离子和两种半导体材料——硅和锗。半导体材料是很重要的,因为原子内部某些电子的形态,决定该材料如何传导电流。
在学完本节内容后,休应该能够:参与讨论原子的基本结构;定义出原子核、质子、中子和电子;说明元素的原子序数;说明电子的能阶;说明何谓价电子;说明离子化现象;说明何谓自由电子。
原子是能够保持元素特性的最小粒子。已知的109种元素都拥有原子,而且每个元素的原子与别的元素都不相同。这使得每一种
元素都拥有唯一独特的原子结构。依照古典玻尔的模型, R02115原子拥有一种像星体运行的结构,原子中心是原子核而周围是按照轨道并按轨道运行的电子,如图1.1所示。原子核是由带正电荷的粒子(称为质子)和不带电荷的粒子(中子)所组成。带负电的基本粒子称为电子。

每一种原子都拥有一定数目的电子和质子,而且与其他元素的原子都不相同。例如,最简单的原子就是氢原子,只有一个质子和一个电子,如图1.2(a)所示。另一个例子就是氦原子,如图1.2(b)所示,原子核有两个质子和两个中子,另有两个电子围绕着该原子核运行。

1.原子序数
所有元素在周期表上都是按照原子序数排列。原子序数( atomic number)等于原子核申质子的数目,也等于电平衡(电中性)时原子所拥有的电子数目。例如,氢的原子序数是1而氦的原子序数是2。在正常(中性)情况下,元素的所有原子都拥有相同数目的质子与电子;正电荷就会与负电荷互相抵消,于是原子就不带任何净电荷。
2. 电子能阶层和轨道
电子绕着与原子核某些特定距离的轨道运行。电子越接近原子核,则它所具有的能量较远离原子核的电子能量越低。我们知道在原子结构中,电子只拥有分散且特定的能量。因此,电子必须绕着几个离原子核特定距离的轨道(orbit)运行。
每个距原子核特定的距离(轨道)就会对应一个能阶。在原子内,这些轨道会分群归纳为数个能量带,称为能阶层。原子都具有固定数目的能阶层。每个能阶层在允许的能阶上(轨道),都只能容纳一定上限数目的电子。在同一个能阶层内的能阶之间存在的能量差,远小于能阶层之间的能量差。能阶层按照1、2、3…顺序编号,能阶层1最接近原子核。能阶层也有用K、L、M--等字母编号,能阶层K最接近原子核。在图1.3中,说明这种能阶层的观念,图中显示出第一个能阶层含有一个能阶,而第二个能阶层含有两个能阶。依照不同的元素,不同形态的原子就存在着不同数目的能阶层。

3. 价电子
远离原子核轨道的电子具有较高的能量,比较接近屎子核的电子所受到的束缚力较大。这是由于带正电荷的原子核和带负电荷的电子之间的吸引力,随着与原子核之间距离的增加而减小。具有最高能量的电子都位于最外层的能阶层,相对地受到原子的束缚力也较少。这个最外的能量层就是所谓的价能阶层( va-lence shell),而位于此能量层的电子称为价电子(valence electrons)。这些价电子促成化学反应和材料结构中的键结( bonding)构成,因此决定了材料的电特性。
4.离子化
当原子从热源或光源吸收能量后,电子的能量就会提升。价电子受到原子的束缚力较内层电子微弱,当吸收到足够的外界能量后,就很容易地跳到价能阶层中更高的能阶轨道上。
如果价电子获得充分的能量,它就能够实际脱离最外层的能阶层和原子核的束缚。价电子的离开,会让先前属于电中性的原子变成带正电荷的状态(此时质子的数量多于电子)。失去价电子的过程就是所谓的离子化(ionization),而形成的带正电荷的原子就称为正离子。例如,代表氢的化学符号是H。当一个中性的氢原子失去它的价电子而成为正离子时,就将它表示为H+。脱离的价电子就称为自由电子。当自由电子失去能量,并且落回到呈电中性氢原子钋层的能阶层时,此氢原子就带有负电(因为,此时电子数量多于质子),称为负离子,表示为H-。
5. 每个能阶层所拥有的电子数
原子的每个能阶层所能容纳最多电子的数目,是自然现象,可以按照下述的公式计算出来:
Ne=2n2 (1.1)
其中,n是能阶层的编号。最内层的能阶层编号为K,再外一层编号为L,如此排列下来。最内层的能阶层能够容纳的电子数最多为
Ne=2n2=2(1)2=2
第二层的能阶层能够容纳的电子数最多为
Ne=2n2 =2(2)2 =2(4) =8
第三层的能阶层能够容纳的电子数最多为
Ne=2n2=2(3)2=2(9)=18
第四层的能阶层能够容纳的电子数最多为
Ne=2n2=2(4)2=2(16)=32
原子除了最外一层(价)能阶层外,所有内部的能阶层都需要填满电子。
上一篇:半导体、导体和绝缘体
 热门点击
热门点击
- 电压倍增器
- 齐纳二极管
- 晶体三极管结构及工作原理简述
- 照明开关的选择与安装
- 晶体三极管的特点是具有电流放大作用
- 电源滤波器与稳压器
- 齐纳二极管通常当作一种稳压器使用
- 绝缘配合的基本概念
- 共发射极放大器的特性
- SF6全封闭组合电器的分类
 推荐技术资料
推荐技术资料
- DFRobot—玩的就是
- 如果说新车间的特点是“灵动”,FQPF12N60C那么... [详细]


 公网安备44030402000607
公网安备44030402000607





